Chủ đề nóng
- Đăng nhập
- Đăng ký
- ×
Vui lòng đăng nhập hoặc đăng ký để gửi bình luận
Khi nhấn đăng nhập đồng nghĩa với việc bạn đã đồng ý với điều khoản sử dụng của báo Dân Việt
Đăng nhập
Họ và tên
Mật khẩu
Mã xác nhận

Khi nhấn đăng ký đồng nghĩa với việc bạn đã đồng ý với
điều khoản sử dụng của báo Dân Việt
Đăng ký
Xin chào, !
Bạn đã đăng nhập với email:
Đăng xuất
Công ty Nanogen khẳng định không cắt bớt giai đoạn thử nghiệm vaccine Nanocovax
Bạch Dương
Thứ tư, ngày 23/06/2021 19:03 PM (GMT+7)
Sau khi hoàn thành pha 3 với kết quả tốt, Nanogen sẽ tiếp tục kiểm định kết quả của Nanocovax, sau đó mới bắt đầu quy trình xin phép Bộ Y tế và Hội đồng đạo đức cấp giấy phép khẩn có điều kiện cho phép lưu hành vaccine Nanocovax.
Bình luận
0
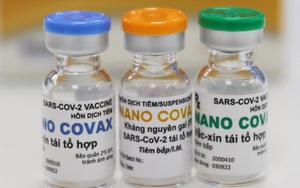
Vaccine Nanocovax (Ảnh: Nanogen)
Trao đổi với báo chí ngày 23/6, ông Hồ Nhân, Tổng Giám đốc Công ty Nanogen cho biết, vaccine Nanocovax đang tiến hành thử nghiệm giai đoạn 3 và đạt khả năng bảo vệ cao là điều khả thi.
Từ tháng 4/2020, Công ty Nanogen bắt tay tìm hiểu nghiên cứu thuốc và vaccine ngừa virus SARS-CoV-2. Đến giữa tháng 12/2020, sau nghiên cứu, sản xuất và thử hàng loạt trên con vật thành công, Bộ Y tế chính thức cho phép thử nghiệm vaccine ngừa Covid-19 do Nanogen sản xuất trên người giai đoạn 1.
Ngày 8/2/2021, Nanocovax hoàn thành 120 mũi tiêm thử nghiệm lâm sàng giai đoạn 1 trên 60 tình nguyện viên. Đại diện nhóm nghiên cứu trình bày kết quả rằng: Cả 3 liều tiêm 25mcg, 50mcg và 75mcg có độ an toàn đạt 100%, hiệu quả bảo vệ người tiêm không bị nhiễm virus SARS-CoV-2 lên đến 90% và tất cả đều sinh miễn dịch tốt.
Hầu hết các tình nguyện viên đều có sức khỏe ổn định sau tiêm. Một số ít trường hợp có biểu hiện đau tại vị trí tiêm, sốt nhẹ, nhưng đều hết sau 1-2 ngày.
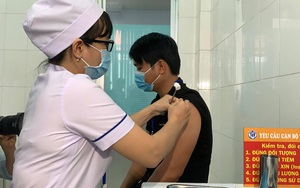
Đến ngày 26/2/2021, thử nghiệm lâm sàng giai đoạn 2 của Nanocovax được bắt đầu tại Trung tâm y tế huyện Bến Lức (Long An). Mũi 2 được thực hiện sau 28 ngày kể từ mũi tiêm đầu tiên trên 500 tình nguyện viên, từ 18 – 65 tuổi và vẫn tiếp tục sử dụng cả 3 nhóm liều.
Kết quả thử nghiệm cho thấy, vaccine an toàn, 100% tình nguyện viên đều sinh miễn dịch, tỷ lệ chuyển đổi huyết thanh đạt đến 99,4% và kháng thể sinh ra có thể chống lại virus SARS-CoV-2 và các biến chủng mới. Các phản ứng phụ của Nanocovax thấp, chưa ghi nhận trường hợp nào sốc phản vệ, các trường hợp có sốt đều rất nhẹ từ 37,5-38 độ C và tự hết.
Dựa trên kết quả rất tốt của pha 1 và pha 2, trưa 11/6/2021, Bộ Y tế chính thức phê duyệt đề cương thử nghiệm giai đoạn 3 vaccine Nanocovax (liều 25 mcg/mL). Pha 3 sẽ được thử nghiệm trên 13.000 tình nguyện viên. Hiện tại, 1.000 tình nguyện viên đã hoàn thành mũi tiêm thứ 2. Ngày 15/6, Viện Pasteur TP.HCM tiêm thử nghiệm ở Bệnh viện đa khoa huyện Bến Lức (Long An) và tiếp tục tiêm thử nghiệm tại Mỹ Tho và Chợ Gạo.
"Nanogen đang cố gắng đẩy nhanh tiến độ nhưng đảm bảo không cắt đoạn hay bỏ sót giai đoạn, đảm bảo độ an toàn và chính xác cao của pha 3. Công ty dự kiến và hy vọng vào tháng 9 sẽ hoàn thành thử nghiệm lâm sàng pha 3 này", ông Nhân cho biết.
Sau khi hoàn thành pha 3 với kết quả tốt, Nanogen sẽ tiếp tục kiểm định kết quả của Nanocovax và sau đó mới bắt đầu quy trình xin phép Bộ Y tế và Hội đồng đạo đức cấp giấy phép khẩn có điều kiện cho phép lưu hành Nanocovax.

Một khâu trong thử nghiệm vaccine Nanocovax (Ảnh: VGP)
Lý giải về việc gửi kiến nghị cấp phép khẩn cấp vaccine lên Thủ tướng, đại diện Nanogen cho biết là bởi biết trước Bộ Y tế không đồng ý. Công ty này còn cho rằng, kiến nghị thể hiện sự mong muốn lớn nhất của đơn vị, đồng thời thay mặt cho người dân để sớm có vaccine phòng Covid-19, an tâm quay trở lại cuộc sống.
Nanogen khẳng định trong suốt quá trình thử nghiệm đều có báo cáo hằng ngày về Cục Khoa học công nghệ và đào tạo (Bộ Y tế). Các yếu tố về an toàn, sinh miễn dịch, hiệu quả bảo vệ đều thực hiện đáp ứng đúng hướng dẫn của Tổ chức Y tế thế giới (WHO).
Và kiến nghị này cũng xuất phát từ cơ sở đánh giá từ Học viện Quân y và Viện Pasteur TP.HCM, hai đơn vị độc lập được Bộ Y tế chỉ định trực tiếp thử nghiệm đánh giá.
Giải thích về quy trình sản xuất vaccine Nanocovax, ông Hồ Nhân cho biết, Nanogen sử dụng công nghệ sản xuất vaccine bằng kháng nguyên, sử dụng tế bào CHO-một loại tế bào có thiết kế gần như tế bào người làm môi trường tạo nên protein gai S. Protein gai S tạo ra từ tế bào CHO có chất lượng tốt (giống gai S thật) nên sẽ kích thích được khả năng đáp ứng miễn dịch cao cho cơ thể khi tiêm vaccine.

Tiêm thử nghiệm vaccine Nanocovax đợt 2 ở Long An (Ảnh: Nguyễn Thủy)
Protein gai S sau đó được thu hoạch, tinh sạch và trộn cùng tá dược để tạo nên thành phẩm vaccine. Do không dùng bất kì thành phần sống nào của virus nên Nanocovax an toàn và không gây ra bất kỳ tác dụng phụ nghiêm trọng nào.
Ông Hồ Nhân khẳng định: "Cách làm vaccine bằng cấy gene trực tiếp tuy nhanh hơn nhưng tính mạo hiểm cao hơn nhiều. Mục tiêu mà Nanogen hướng tới là tạo nên vaccine có thể bảo vệ cơ thể 100%".
Nanogen là công ty tư nhân đầu tiêm tham gia nghiên cứu và sản xuất vaccine phòng Covid-19 của Việt Nam. Công ty dự kiến đến cuối năm 2021 sẽ sản xuất được 50 - 100 triệu liều vaccine Nanocovax với giá bán thấp nhất thế giới: 120.000 đồng/liều.
Về việc Công ty cổ phần công nghệ sinh học dược Nanogen (Công ty Nanogen) đề xuất Thủ tướng cấp phép khẩn cấp cho vắc xin Covid-19 Nano Covax, tối 22/6, TS Nguyễn Ngô Quang - Phó cục trưởng Cục Khoa học công nghệ và đào tạo (Bộ Y tế) - khẳng định: "Kiến nghị là quyền của doanh nghiệp, còn việc cho phép hay không thuộc thẩm quyền của các cơ quan chuyên môn, căn cứ theo các quy định.
Việc ra quyết định cấp phép khẩn cấp một loại vắc xin phụ thuộc vào rất nhiều yếu tố. Để quyết định có cấp phép khẩn cấp hay không, Bộ Y tế cần có các dữ liệu khoa học".
Theo ông Quang, việc cấp phép vắc xin phải trả lời được 3 câu hỏi lớn. Đó là: Có an toàn không? Có sinh miễn dịch không? Và điều đặc biệt quan trọng đó là có hiệu lực bảo vệ không? Cho dù trong bối cảnh dịch Covid-19 cấp bách như hiện nay cũng vẫn phải dựa trên nguyên tắc đầy đủ các dữ liệu khoa học, trả lời được 3 câu hỏi trên.
Ông Quang nhận định, vắc xin Covid-19 Nano Covax do Công ty Nanogen sản xuất mới đang thử nghiệm giai đoạn 3a. Cụ thể là mới thử nghiệm trên 1000 người. Đây là số lượng nhỏ chưa mang tính cộng đồng so với hàng trăm triệu người sử dụng vắc xin sau này.
Đề cương thử nghiệm giai đoạn 3 mà Bộ Y tế phê duyệt (ngày 11/6) cần thử nghiệm trên 13.000 người. Đồng thời cũng cần có thời gian để đánh giá tính sinh miễn dịch và hiệu lực bảo vệ của vắc xin. Để có đủ căn cứ khoa học đánh giá cần phải theo dõi sau tiêm mũi 1 sau 36 ngày, 45 ngày và 56 ngày.
"1.000 người chưa nói lên điều gì nhiều", ông Quang nói.
Theo ông Quang, quan điểm của Bộ Y tế cũng như cá nhân ông là hoàn toàn ủng hộ cho sự nghiên cứu phát triển vắc xin Covid-1 trong nước để chủ động được nguồn vắc xin của Việt Nam. Tuy nhiên, để có 1 vắc xin tiêm rộng rãi cho người dân, về nguyên tắc Bộ Y tế phải có các dữ liệu về an toàn, tính sinh miễn dịch và đặc biệt là hiệu lực bảo vệ. Mục tiêu của ngành y tế là bảo vệ sức khỏe người dân nên phải hết sức cân nhắc giữa lợi ích và nguy cơ.
Ông Quang cũng đánh giá hiện nay các dữ liệu thử nghiệm giai đoạn 1 và 2 của vắc xin Covid-19 Nano Covax là an toàn, có tính sinh miễn dịch nhưng hiệu lực bảo vệ như nào vẫn đang trong thời gian nghiên cứu, thử nghiệm tiếp.
Mời các bạn đồng hành cùng báo Dân Việt trên mạng xã hội Facebook để nhanh chóng cập nhật những tin tức mới và chính xác nhất.
Tin cùng chuyên mục
Xem theo ngày
Xem
Tin nổi bật